红参Ginseng Radix et Rhizoma Rubra为五加科植物人参Panax ginseng C. A. Mey.的栽培品经蒸制后的干燥根和根茎,主产于吉林抚松、集安、靖宇、长白山等地。经蒸制后的红参药性由微温转温,补气效果增强,具有大补元气、复脉固脱、益气摄血的功效,用于体虚欲脱、肢冷脉微、气不摄血、崩漏下血等症。
现有研究表明,红参主含皂苷类,还有糖类、氨基酸、挥发油、多肽、微量元素等化学成分,具有增强免疫、抗肿瘤、抗氧化、抗糖尿病、抗肝肾毒性等药理作用
[1]。其中,人参皂苷是红参和人参质量评价的重要指标,由于其种类繁多,一直是人参属植物中活性成分研究的热点。《中国药典》2020年版中对红参、人参均以人参皂苷Rg1、Re和Rb1作为含量测定项[2],且限量规定基本一致,缺少对红参中专属性成分的把控,未能在质量标准中体现红参区别于人参的质量差异,因此对红参的炮制工艺及炮制后皂苷类成分的转化进行研究和优化具有重要意义。
目前,国家及各地方标准红参的炮制工艺参数规定不一,本文梳理了红参炮制工艺及其质量评价方法的相关研究进展,结合皂苷类成分在红参中转化的特点,总结了影响皂苷类成分转化的炮制工艺参数,检测方法在皂苷类成分中的应用,以期为红参炮制工艺优化和质量评价新指标的挖掘提供依据。
1 红参炮制工艺研究
1.1 历史沿革
人参是五加科植物人参P. ginseng C. A. Mey.的干燥根和根茎[2],药用首载于《神农本草经》:“人参,味甘微寒,主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智,久服,轻身延年。”人参最早的炮制加工方法可追溯至汉代,历代加工方法也各有不同,如南北朝雷公曰“去四边芦头并黑者,锉入药中”,唐代《外台秘要》开创“切焙法”,宋代《本草图经》主张“制炭、焙、微炒”,元代《世医得效方》则采用“蜜制法”[3]。而红参作为人参的主要炮制品种之一始载于明代《本草蒙荃》:“紫团参,紫大而稍扁”,而后在《绝域纪略》和《宁古塔纪略》中记载道:“掘人参之人,一日所得,至晚便蒸,次早,日中晒,晒干后有大有小,有红有白。”“人参以八九月间者为最佳,生者色白,蒸熟辄带红色。红而明亮者,其精神足,为第一等。凡掘参者,一日所得晚即蒸,次晨晒于日中,干后有大小、红白不同,非产地之异,故土人贵红贱白[4]。”可见蒸制法是人参炮制成为红参的传统方法。
1.2 现代炮制方法
收载情况
现代红参的工艺流程包括选参、洗净、蒸制、干燥、包装等步骤,而历版《中国药典》及地方炮制规范都对红参炮制工艺参数的描述存在一定差异,并且大多简单粗略,缺少蒸制温度、时间、干燥条件等关键的工艺参数,具体见表1。现有研究表明,蒸制温度、时间、干燥条件等因素都会对红参的外观性状、皂苷类成分的含量、组成造成不同程度的影响。为保证红参的质量稳定性,需对红参的炮制工艺进行深入而系统的研究,明确其炮制机制与成分转化,为红参的炮制工艺与质控指标提供依据。
1.3 红参炮制过程中人参皂苷的转化研究
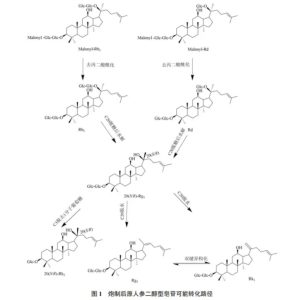
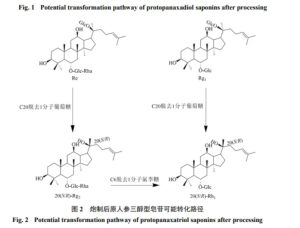
人参皂苷是人参属植物的主要活性成分,目前已从人参和红参中分离提取出几百种人参皂苷[5],主要分为原人参二醇型、原人参三醇型和齐墩果酸型皂苷,见表2。红参中除了存在常见的人参皂苷Rb1、Rg1、Re、Rb2、Rc、Rd、Ro、Rf等,还存在一些特有人参皂苷如20-(R/S)-Rg3、Rk1、Rk2、20-(R/S)-Rh2、Rg5等,研究发现在鲜人参炮制加工成红参过程中,常见人参皂苷会发生一系列脱糖化、水解、双键异构化等反应,转化生成相对应稀有人参皂苷[6]。
人参中的丙二酰基(malonyl,m)人参皂苷是一类极性大、亲水性强,极易溶于水的酸性皂苷,在酸、碱或加热条件下,C-3酯键水解脱去丙二酸,并生成相应的人参皂苷[7]。根据已有研究报道可推测在红参蒸制过程中,脱去丙二酸的原人参二醇型人参皂苷Rb1、Rd的C-20脱糖后水解生成20-(R/S)-Rg3,C-3再脱去1分子葡萄糖生成20-(R/S)-Rh2,或C-20进一步脱水生成Rk1和Rg5,见图1;原人参三醇型人参皂苷Re的C-20脱去1分子葡萄糖生成20-(R/S)-Rg2,20-(R/S)-Rg2脱去1分子鼠李糖或Rg1的C-20直接脱去1分子葡萄糖即可生成20-(R/S)-Rh1[8],见图2;由于人参皂苷的C-20羟基的空间排列差异,某些人参皂苷存在S、R 2种异构体,且在炮制过程中C-20侧链环合,S构型向R构型转化,但由于目前对人参皂苷构效关系研究较少,其转化程度未知[9]。对于齐墩果酸型人参皂苷,还没有对其化学转化进行系统研究,但有研究人员结合从红参中提取到的齐墩果酸型皂苷推测可能的转化路径为人参皂苷Ro的C-28或C-3脱去1分子葡萄糖生成姜状三七皂苷R1或竹节参皂苷IVa,C-3或C-28再脱去1分子葡萄糖生成金盏花苷E[8]。
1.4 红参炮制工艺对质量的影响
1.4.1 蒸制条件对红参质量的影响
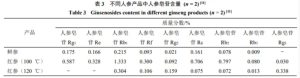
蒸制作为红参炮制加工最为重要的环节对红参质量起到决定性作用,蒸气温度、蒸制时间等参数会使红参样品的外观性状和成分存在差异。孙慕白等[10]采用单因素考察试验法分别探究红参炮制工艺中温度和时间因素对总皂苷含量的影响,结果表明蒸制时间对人参皂苷含量有显著影响;提取时间对人参皂苷含量影响较小,但是影响红参的外观性状;蒸制温度过高,红参失水过快,易导致外表产生许多纵皱纹,颜色过暗,使得外观不符合规定。Xu等[11]考察了鲜人参分别在100 ℃蒸制3 h与120 ℃蒸制3 h,人参皂苷从鲜人参到红参的转化情况,相比之下,经过更高温处理后,红参中表现出大量极性较小的皂苷类化合物,如人参皂苷Rg3、Rh2等,却没有检测到人参皂苷Rg1和Re,说明温度确实影响了人参皂苷的转化,具体见表3。
Lee[12]将鲜人参在100 ℃下蒸制0、1、2、3、4、5、6 h,发现人参皂苷Rb1含量随蒸制时间增加而增加,而m Rb1含量显著降低,同样人参皂苷Rc、Rd、Rb2等原人参二醇型人参皂苷含量也有不同程度的增加,转化人参皂苷Rg2、Rh1、Rb3等含量逐渐增加,天然人参皂苷Rg1、Re、Rb1、Rc、Rd等含量逐渐减少。
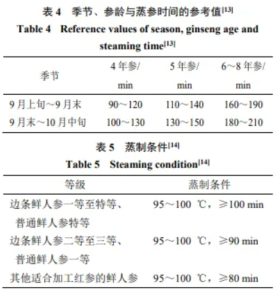
綦占文等[13]认为具体的蒸参参数应根据实际情况而作出改变,如特大的鲜人参为防止蒸制过程中爆裂应注意缓慢升温;随季节和参龄的变化,人参营养物质比例也会发生改变,蒸参参数也应当随之调整,见表4。我国农业部《红参加工技术规范》从原材料的等级规格上对蒸制条件进行规定,见表5[14]。
综上所述,由于历版《中国药典》及地方炮制规范未对原材料鲜人参的生长年限、规格大小进行规定,使得完善炮制规范极为困难。
1.4.2
干燥条件对红参质量的影响 干燥也是加工红参的重要环节之一,干燥温度过高,外皮易焦化,色泽深暗,光泽差;干燥速度过快,外部先干形成角质,导致参体内水分不挥发使参体膨胀、鼓起,形成空心或破肚子,造成红参的产量和质量下降。因此,红参干燥条件及方式的研究十分必要[15]。
传统人参炮制品采用晒干、阴干等自然干燥方式,随着现代加工技术的发展,新型干燥技术如冷冻干燥、鼓风干燥、微波干燥等方式为不同类型中药材加工提供了更多选择。冷冻干燥在完全真空的状态下通过水的升华达到干燥的目的,一定程度上能够防止有效成分流失;鼓风干燥通过鼓风机的送风、加热系统的加热升温、排风系统的排出快速带走药材中的水分和湿气[16]。
徐新房[17]考察了红参在50、60、70、80 ℃的烘干条件下人参皂苷Re、Rg1、Rb1的含量及冷冻干燥、鼓风干燥方式对红参外观性状的影响,发现红参在80 ℃下烘干为最佳,冷冻干燥相比鼓风干燥时间更短、表面没有凹陷皱缩等现象。Ning等[18]在鼓风干燥和自然晒干的基础上研究了远红外干燥,结果表明随着远红外干燥温度的升高,干燥速率加快,但较高的温度使红参产生较大的色差值及较高的皂苷损失率;而自然晒干表现出良好品质的同时效率也远远低于鼓风和远红外干燥,相同干燥温度下,鼓风干燥的品质劣于远红外干燥,因而综合考虑多方面因素,该作者认为不超过60 ℃的远红外干燥法提升了红参的品质和生产效率。
综上,在选择和优化红参干燥条件及方式时应综合考虑不同方式对红参有效成分变化和外观性状的影响,并且不能忽略在大生产中成本、效率等因素。
1.4.3
炮制工艺优化 基于上述不同炮制工艺对红参内在成分的显著差异,许多研究人员对红参炮制工艺优化展开研究,但由于各自评价指标不同,炮制工艺参数具有多样性,见表6。
李卓艳等[19]以人参总皂苷和高活性人参皂苷Rg3为指标,对红参蒸制时间、烘干温度、烘干时间进行条件优选,得到蒸制4 h,70 ℃干燥8 h为最佳工艺的结论。侯新莲等[20]建立高效液相色谱指纹图谱,在100 ℃蒸制150 min,60 ℃干燥的条件下,人参皂苷Rg1、Re、Rb1的指纹图谱与对照图谱的相似度大于0.970,且在该工艺条件下的炮制红参与市售优质红参质量一致(指纹图谱相似度大于0.9),即认为该工艺为最优工艺。孟迪等[21]选用高压蒸汽灭菌锅对红参炮制工艺进行改进,发现在102 ℃蒸制5 h,烘干10 h的条件下人参总皂苷的含量最高。
张宪臣[22]研究发现在炮制过程中蒸制时间对人参总皂苷的影响大于烘干时间和烘干温度,蒸制时间越长人参总皂苷的含量损失越大,当蒸制3 h,烘干温度为60 ℃,烘干10 h的条件下人参总皂苷的含量最高。石婧婧等[23]采用超快速液相色谱-三重四级杆/线性离子阱质谱结合灰色关联度分析和TOPSIS法探讨不同加工设备和方法对红参质量的影响,发现最优的蒸制设备为蒸参柜,最优的干燥设备为热风循环烘箱,升温时间30 min,蒸制时间70 min,烘干温度55 ℃,烘干时间20 h为最佳工艺条件。可见人参总皂苷、人参皂苷Rg1、Re、Rb1、Rg3含量成为较常用来考察红参炮制程度的指标,然而红参炮制过程中,常见人参皂苷和稀有人参皂苷含量和组成都有不同程度的变化,单一指标并不能够整体评价炮制条件的优劣与否。因而,在化学成分研究控制炮制质量较为困难的情况下可以结合药理药效学研究,从而更全面地指导红参炮制工艺改革。
2 红参质量评价指标选择
中药质量安全是保证临床应用安全有效的前提,但由于中药基原复杂、种植加工不规范、掺伪严重等问题使得中药材质量难以保证。现行《中国药典》对红参药材的质量评价标准包含来源、性状鉴别、显微鉴定、农药残留检测、含量测定,缺一不可。随着现代分析技术和中药质量评价方法的快速发展,相比较为主观的传统性状鉴别,学者们对可准确量化的有效成分含量测定及生物效应评价更为关注。
人参在炮制成红参过程中发生了一系列反应,使得红参中的人参皂苷种类和含量明显区别于人参。《中国药典》2020年版将人参皂苷Rg1、Re、Rb1作为人参和红参的含量测定指标,且人参皂苷Rb1限度标准相同,无法体现红参的炮制意义。因而,从外观性状、理化指标、生物评价3个不同方面对红参进行全面质量评价对规范红参炮制标准、质量控制及临床正确用药具有重要意义。
2.1 外观性状
由于受到人参生长、加工、贮藏等条件影响,有些红参外层会形成黄色外皮,俗称“黄马褂”[27]。我国《人参商品规格标准》对一、二、三等红参的描述为“无黄皮”“稍有黄皮”“有黄皮”,《红参分等质量》对特等、一等、二等红参外观性状要求分别为“表面半透明,红棕色,有自然光泽,无抽沟,无黄皮”“表面半透明,红棕色,有自然光泽,抽沟、黄皮不超过主根的1/3”“红棕色无光泽,有抽沟,有黄皮”,可见红参的外观性状会影响其经济效益,但目前没有研究阐明黄皮对红参内在质量是否存在影响,因此有必要从传统经验鉴别与有效成分含量之间的关联对药材进行整体质量评价[28-29]。
白羽辛等[30]分析了红参的外观性状与化学成分的相关性,主根中的人参皂苷Rg1、Re、Rf、Rb1、Rh1、Rc及支根中的人参皂苷Rb1、Re与其色度值L*、a*、b*呈显著或极显著负相关(L*、a*、b*越大,粉末颜色越偏白、偏红、偏黄),表明红参主根及支根中人参皂苷含量越低。然而,目前没有更多研究阐明红参外观性状与人参皂苷含量之间的因果关系,仍是亟待解决解决的问题之一。
2.2 理化指标
张凡等[31]采用超高效液相-四级杆-飞行时间串联质谱结合多元统计方法考察人参蒸制前后人参皂苷类成分的变化。通过UNIFI信息平台结合多元统计全面筛选生晒参与红参样品,实验发现生晒参和红参存在明显差异,并鉴定出21种能够区分生晒参与红参的潜在标记物,具体见表7。该实验提出的方法为深入研究人参与红参的化学成分提供了参考,然而该实验的样本量较小,且未对所有特征性成分进行定量分析,其适用性与通用性需要进一步研究验证。
由于红参在炮制过程中生成了一些更富有生物活性的小分子稀有人参皂苷,研究人员认为将其含量纳入红参的质量评价标准能够更全面地评价红参质量。高天阳等[32]测定了29批红参药材中12种皂苷类成分,其中包含人参皂苷Rg3、Rg5、Rh2 3种红参中特有的稀有皂苷,其含量范围分别在0.001%~0.027%、0.003%~0.031%和0.012%~0.101%,发现不同批次间人参皂苷含量差异较大,将稀有人参皂苷作为评价指标也有待商榷。
Xie等[33]测定了不同蒸制条件下商品红参和实验室红参丙二酰人参皂苷含量与中性人参皂苷含量的比值,认为该比值可用于规范红参的加工工艺,然而丙二酰基人参皂苷具有不稳定性,提取温度、加工条件、储藏时间都会使其产生降解,含量测定并不准确,不能够反映人参和红参的真实质量水平[34]。
2.3 生物评价
中药生物活性成分包括有效成分、毒性成分以及其他可能对机体代谢功能产生影响的成分。生物活性成分不仅是保证中药有效性的前提,也是中药发挥临床疗效的重要保障。与单一的理化指标相比,生物评价模式更能体现中药多成分、多靶点的特征,从整体上对中药成分进行总体药效作用评价[35]。生物检定统计法是利用生物体评估药物生物活性的一种方法,以药物的药理作用为基础,以生物统计为工具,运用特定的实验设计,通过等反应剂量间比例的运算或限值剂量引起的生物反应程度,从而测定供试品的效价、生物活性或杂质引起的毒性[36]。
人参和红参作为补益要药在抗炎、抗氧化、保护神经细胞等方面疗效显著[37]。Huang等[38]通过细胞外通量分析仪实时监测活细胞线粒体呼吸来评价不同提取溶剂对人参提取物调节心肌细胞线粒体功能的作用,发现人参90%乙醇提取物对心肌细胞线粒体呼吸的促进作用最强,显著提高心肌细胞对氧化损伤的耐受性。Zhang等[39]通过透射电镜观察小鼠海马神经元线粒体损伤程度和线粒体自噬溶酶体数量发现人参皂苷Rg2能显著恢复D-半乳糖诱导的小鼠记忆功能受损、胆碱功能障碍和氧化还原系统失衡。王怀瑞[40]考察了生晒参和红参中的活性成分对α-淀粉酶的抑制程度,发现生晒参对α-淀粉酶的抑制能力明显高于红参,并通过其代谢途径推断由于蒸制和高温致使人参皂苷的糖苷键断裂并转化为其对应的人参皂苷苷元使得炮制后红参对α-淀粉酶的抑制活性降低。由于药物代谢的复杂过程使得药物成分发生变化并最终影响药理作用及临床应用效率,Li等[41]改进了人参皂苷的微流体共培养系统,对其进行代谢分析,通过重述天然产品的代谢过程和药理活性来提供一个新的体外药物筛选平台,研究发现高浓度的CK、Rh2(S)和Rg3(S)人参皂苷对2种类型的肿瘤细胞表现出显著的抑制作用;此外,凋亡检测表明,通过肝脏代谢的Rg3(S)人参皂苷促进了肿瘤细胞的早期凋亡,并显示更好的抗癌活性,这套改进后的微流体共培养系统可能广泛应用于对天然药物早期发育阶段的抗癌活性和药物代谢进行生物活性评估。
中医药理论和临床实践是落实中药质量标准的2个必备要素。不同于化学药品的评价体系,中药成分较多、结构复杂,单纯的主成分分析而忽略其整体功效无法保证中药的高质量应用,也使得建立完善的中药质量评价体系尤为困难。有研究提出了“性状-质量标志物-生物效应”的评价方式[42],将不同产地、年限、炮制方法下红参的性状、化学指标、生物效应三者关联,找寻与药效相关性强的生物活性指标和与外观性状相关性强的化学成分指标,从而最大程度上改善红参质量评价体系的整体性和专属性。
3 红参质量评价分析技术研究进展
人参皂苷是目前红参的关键质量评价指标,关于人参皂苷的分析方法有高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet,HPLC-UV)、高效液相色谱-蒸发光散射检测法(high performance liquid chromatography-evaporative light-scattering detector,HPLC-ELSD)、高效液相色谱-电喷雾式检测器法(high performance liquid chromatography- corona charged aerosol detection,HPLC-CAD)、高效液相色谱-质谱检测法(liquid chromatograph mass spectrometer,LC-MS)、二维液相色谱(two-dimensional liquid chromatography,2D-LC)、近红外光谱技术(near infrared,NIR)、一测多评法(quantitative analysis by multiple system,QAMS)等,见表8。
3.1 HPLC-UVHPLC-UV
由于其灵敏度较高、稳定性好、适用范围广等特点成为人参皂苷最常用的分析方法。然而,由于人参皂苷的多样性和弱紫外吸收等特点,HPLC-UV对含有多种人参皂苷的化合物存在分离度不好,基线漂移,分离时间长等缺点,《中国药典》2020年版采用HPLC-UV对人参、红参药材进行含量测定,梯度洗脱时长高达100 min[2]。
3.2 HPLC-ELSD
ELSD是一种新型通用检测器,可以很大程度上克服皂苷类、糖类、内酯类等成分在传统UV检测法中无生色团、弱紫外吸收等缺点,目前,蒸发光散射检测器已在中药分析与质量控制领域广泛应用[45]。刘璐等[52]建立了HPLC-ELSD法同时测定胃康颗粒中人参皂苷Rb1和黄芪甲苷的含量,优化了《中国药典》2020年版中分别采用的HPLC-UV法测定三七中人参皂苷Rb1的含量和HPLC-ELSD法测定黄芪中黄芪甲苷的含量,该方法操作简便、节省了分析时间,为中成药颗粒指标性成分含量测定和质量控制提供了参考。然而,蒸发光散射检测器也存在一些不足,例如,由于流动相需要全部蒸发,流动相的选择受到局限,且其灵敏度没有传统紫外检测器高。
3.3 HPLC-CAD
CAD又称荷电气溶胶检测器,是一种基于雾化- 气溶胶原理的质量型检测器,其信号电流与溶质含量成正比,适用于绝大部分非挥发性和半挥发性化合物含量检测,且其灵敏度高于UV检测器[53]。Xu等[47]将UPLC-CAD法用于119批人参样品中的15中人参皂苷分析,为不同批次的人参产品真伪鉴别提供了有用的信息,可为人参等多来源药材的精准质量控制提供方法参考。
3.4 LC-MS
随着液质联用技术的快速发展,能够准确分析中药炮制前后的活性成分变化、对不同产地的中药材进行溯源分析、区分中药材真伪品等。
Leung等[54]开发了几种采用LC-MS/MS法区分人参属植物的方法,使同分异构体在高效液相色谱- 三重四极杆质谱仪(high performance liquid chromatography-triple quadrupole mass spectrometry,HPLC-QQQ-MS)的定量分析中获得良好的线性响应。尽管在全扫描模式下可以获得化合物的碎片离子信息,但不足以准确阐释化合物的结构信息,因此,结合飞行时间质谱技术(quadrupole time-of-flight mass spectrometry,Q-TOF-MS)对化合物进行精确的质量测定。Li等[55]建立并验证了UPLC-Q-TOF-MS法用于西洋参制剂中掺伪人参的快速定性定量分析,其更高的分辨率和更准确的质量测定有助于人参属植物及其制剂的质量控制。然而,由于质谱仪价格昂贵、操作复杂、维护成本高等特点,很大程度上限制了其在人参皂苷分析检测中的应用。
3.5 2D-LC
由于中药及天然产物的复杂性,对分析仪器、色谱柱要求高,《中国药典》
2020年版新增多维液相色谱,相比一维液相色谱,多维液相色谱能够在短时间内获得更高的峰容量和分离度,实现了新型液相色谱技术的突破性应用,全面有效地提升了中药及天然产物分析的水平[56]。Yang等[49]通过基于QbD分析方法对各种参数(流动相的选择、温度、流速和梯度等)进行优化,建立了一种中心切割二维液相色谱分离技术筛选白参和红参的新型标志物,这种快速、全面的方法可在未来对红参质量控制新指标的挖掘中探索应用。
3.6 NIR
NIR通过对给定样品中含氢基团X-H(X为C、N、O、S)在近红外波长780~2 526 nm振动的倍频和组合频吸收信息进行测量并结合化学计量法对样品进行校正分析。目前,NIR技术凭借其前处理简单、样品无污染、分析快速等特点在人参、红参、西洋参及各类伪品的鉴别中广泛应用[57]。应旭辉等[50]用62批红参样品作为校正集,分别建立水分、人参皂苷和糖类成分的定量模型,对模型进行系统优化,并用另外38批样品作为验证集对建立的模型进行验证和评价,结果显示所建的模型对红参水分含量、人参皂苷Rg1和Re总含量、人参皂苷Rb1含量及麦芽糖和蔗糖总含量均有较好的预测能力。由于NIR技术需要不断更新和补充数据模型以保证预测结果的准确性,使得应用上仍存在局限性,今后将常规化学分析法与NIR技术相结合建立人参属植物专属性的评价方法,实现对其生品、伪品、炮制品的快速准确鉴别以及定量分析,对人参、红参药材的全面质量评价具有重要意义。
3.7 QAMS
QAMS是指利用中药有效成分内在函数关系和比例关系,只测定1个成分从而实现多个成分的同步测定,很好解决了中药材中对照品短缺、昂贵等问题。徐文武等[51]采用QAMS法以人参皂苷Rb1为内参物同时测定红参中11种人参皂苷的含量,其中包含了人参皂苷Rh1、人参皂苷Rb3和人参皂苷Rg3等红参中稀有皂苷,将QAMS含量测定结果与外标法进行了验证,结果表明QAMS测定结果与外标法测定结果无显著性差异,因此QAMS在节省实验成本的同时也能更好地全面评价红参质量。
4 结语
4.1 原材料规格和生长年限不明确,需严格把控历版《中国药典》及地方炮制规范未要求炮制所用原材料鲜人参的规格大小、生长年限,使得炮制结果不尽相同,今后在红参质量控制研究中应深入研究规格大小和生长年限对红参炮制的影响,充分考虑到规格和年限对药材质量的相关性。
4.2 现有炮制工艺尚不完善,亟需规范
随着技术的发展,可用于红参加工的仪器层出不穷,炮制规范未统一,具体参数不明确,不同企业也有自己不同的标准,使得市场上红参质量参差不齐。因此,基于现有红参药材的物质基础,结合现代分析方法深入探索在炮制过程中化学成分、金属元素、氨基酸等物质的转化机制和组分变化,完善红参炮制工艺参数,建立专属性的质量控制指标,确保红参的质量稳定和用药安全的同时也能够促进市场的规范化、标准化。
4.3 质量评价体系不完善,需建立全面质量评价体系
现阶段人参、红参的质量评价研究仍集中于化学成分的含量研究,然而人参属植物的物质基础较为复杂,炮制过程中发生脱糖、水解、异构化等一系列反应,使其富有更广泛的药理活性。未来应当结合最新技术,利用最新手段,从外观性状、理化指标、生物评价3要素建立完善的红参质量评价体系,从而实现红参药材的全面质量控制,为现行中国药典人参、红参的质量标准提高奠定基础,为提升红参药材、饮片、制剂的质控水平提供依据。
利益冲突
所有作者均声明不存在利益冲突
参考文献(略) 来 源:袁佳宝,曹 帅,李丽敏,胡 青,毛秀红,季 申.红参的炮制工艺及质量评价研究进展 [J]. 中草药, 2024, 55(18): 6437-6447.